生物学的精神医学とは、精神障害を生物学的・自然科学的方法によって研究し解明しようとする精神医学の領域のこといいます。 過去には精神疾患の成因や治療について心理社会的側面が強く強調されてきた時代もありましたが、クロルプロマジン(抗精神病薬)や イミプラミン(抗うつ薬)等の治療薬の発展を背景に、精神薬理学研究や生化学研究が行われ、精神疾患の生物学的側面が注目されるようになりました。 疫学観察研究から、精神疾患は遺伝要因と環境要因の相互作用により発症することが示唆されています。近年の分子生物学的研究法の進歩はめざましく、 いくつかの家族性の神経内科的疾患の原因遺伝子が特定されています。しかしながら、精神疾患の診断は症候学に基づいて行われ、 その病態はいまだ十分に解明されていません。治療薬の選択は医師の経験に基づいて行われ、現在の治療薬に十分な反応を示さない患者も多くおられます。 このような状況のなか、精神疾患や治療反応に関わる個々の生物学的背景を明らかにすることは必須であると考えます。
わたしたちは、臨床情報が紐づけされた試料を長年にわたり集積し、分子遺伝学、神経内分泌学、神経生化学、精神神経薬理学、脳画像診断学の手法を駆使して、 精神疾患の病態解明(創薬へ)や診断・治療予後マーカー開発を行い(早期診断や適切な薬物選択へ)、個別化医療の実現を目指して日々研究を行っています。
具体的には、主要な精神疾患である統合失調症やうつ病を対象に、ゲノム解析、エピゲノム解析、遺伝子発現解析、メタボロミクス解析を実施しています。 日本医療研究開発機構(AMED)の「治療抵抗性統合失調症に対する客観的診断・治療法の開発」(代表 橋本亮太)、 「バイオマーカーを利用したうつ病の層別化と治療計画策定法の立案」(代表 大森哲郎)、 「AI技術を活用した統合失調症の早期診断医療機器プログラムの開発に関する研究」(代表 橋本亮太)に参加し、学内外・海外の複数の研究施設と共同研究も積極的に行っています。

1. 疾患感受性候補遺伝子の同定研究
一卵性双生児における統合失調症の発症一致率は48%程度であり、遺伝率が約80%にまで及ぶと推定されていることから、 統合失調症患者のゲノム解析は有望な研究手法の1つです。Commonな変異は疾患発症に小さい影響があり、 まれな変異は疾患発症に大きな影響があることが分かってきており(図1)、統合失調症の疾患感受性候補遺伝子の同定には両方向からアプローチが必要です。 わたしたちは、これまでに、commonな変異では、メチレンテトラヒドロ葉酸還元酵素遺伝子の機能性多型が統合失調症のリスク遺伝子であることを明らかにしました (Schizophr Bull 2014)。まれな変異では、孤発性患者と両親を対象に次世代シークエンサーを用いたエクソーム解析を行い、 複数のde novo遺伝子変異を同定しました(Sci Rep 2017)。名古屋大学らとの共同研究にて、統合失調症においてゲノムコピー数変異 (CNV)の頻度が高いことを明らかにしました(Mol Psychiatry 2017)。これらの研究成果は、統合失調症の病態解明につながると思われます。
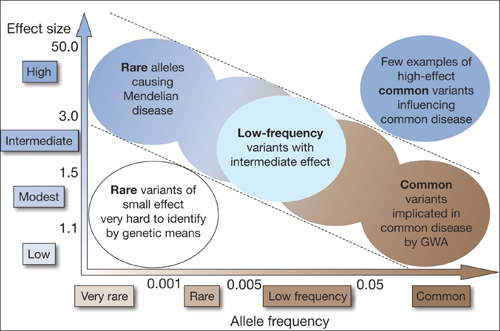
(図1)Manolio TA et al. Nature 2009より引用
2. ファーマコゲノミクス研究
ファーマコゲノミクスとは、治療薬に対する反応に影響するゲノム上の遺伝子多型を明らかにし医療などに応用することを目指した学問です。 わたしたちは、アレイをもちいた大規模遺伝子関連研究(GWAS)を行い、強迫性障害患者の治療反応性に関わる遺伝子多型を同定しました (図2)(PLoS One 2016)。この研究成果は、強迫性障害患者の治療反応予測マーカーの開発につながると思います。 また、AMEDの「治療抵抗性統合失調症に対する客観的診断・治療法の開発」に参加し、藤田医科大学らとの共同研究にて治療抵抗性の統合失調症の 治療薬クロザピンの顆粒球減少症・無顆粒球症に関わる遺伝子多型を同定しました(Biol Psychiatry 2016)。この研究成果は、クロザピンの副作用出現予測につながると思います。
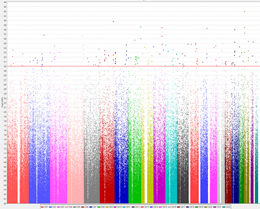
(図2)PLoS One 2016より作成
エピジェネティクスとはDNAの塩基配列によらない遺伝子発現制御に関わる機構である。DNAメチル化はエピジェネティクス機構の1つです。 哺乳類のほとんどのDNAメチル化はシトシン塩基(C)とグアニン塩基(G)の順に並んだCpG配列上のシトシンで起こります。 動物実験では、幼少期のストレスなどの環境要因が特定の遺伝子のDNAメチル化に影響を与え、遺伝子発現や行動を変えることが報告されています。 ストレスは精神疾患に密接に関連しているため、近年、精神疾患のエピジェネティクスの変化が注目されています。 わたしたちは、アレイを用いて網羅的に解析し、末梢血における統合失調症とうつ病のDNAメチル化修飾の特徴を明らかにしました (図3)(Neuromolecular Med 2013, Epigenetics 2015)。これらの研究成果は、環境要因による疾患の分子機序解明につながると思います。 また、大阪大学と共同研究を行い、治療抵抗性の統合失調症の治療薬のクロザピンの投与前後の末梢血と患者由来人工多能性幹細胞(iPS細胞:induced pluripotent stem cell) におけるDNAメチル化修飾の変化を明らかにしました(Int J Mol Sci 2017)。これらの研究成果は、クロザピンの分子薬理作用機序解明につながると思います。 現在は、AMEDの「バイオマーカーを利用したうつ病の層別化と治療計画策定法の立案」に参加し、広島大学らとの共同研究にて抗うつ薬の治療反応にかかわる DNAメチル化修飾の特徴を調べています。この研究成果は、うつ病の治療反応予測マーカーの開発につながると思います。
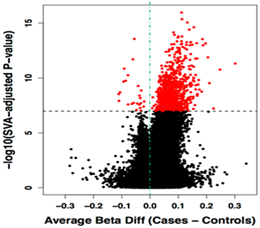
(図3)Neuromolecular Med 2013より作成
DNAの情報がmRNAに転写され、mRNAの情報が翻訳されてタンパク質が合成されます。白血球の遺伝子発現測定の利点は、mRNAが比較的安定して保存でき、 どの遺伝子も同じ方法で短時間に解析でき、試料は数ミリリットル以下の通常採血で十分である点です。 白血球のmRNA発現は、急性の心理ストレス、社会的孤立、幼少期の生活環境などうつ病の危険因子となるストレスの影響を短期的にも長期的にも受けていることが示唆されています。 さらには、末梢血と脳での遺伝子発現はある程度の高い相関が認められることが知られています。わたしたちは、 これまでに、複数の遺伝子においてうつ病群と健常者群との間に末梢白血球の遺伝子発現に違いがあることを明らかにしました。 続いて、これらの遺伝子を含む複数の遺伝子の発現を組み合わせることにより、うつ病患者と健常者をある程度区別できる可能性を示しました (図4)(J Psychiatr Res 2015)。これらの研究成果は、うつ病の診断マーカー開発およびうつ病患者の早期診断・早期治療につながると思います。
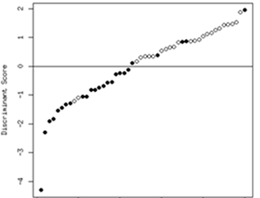
(図4)J Psychiatr Res 2015より引用
メタボロームとは、アミノ酸、ヌクレオチド、糖、脂質などを含む低分子量代謝物質の総であり、分離分析技術の発達により個々の代謝物質定量性が可能になってきました。 タンパク質(約100万種類)や遺伝子発現(約15万種類)などと比較すると、対象となる代謝物の数は少なく(約5000種類)、 遺伝子制御やタンパク質の作用を経た最終的な表現系における代謝物の変動をみることとなるため、環境的要因なども含めた変動を観測できます。 わたしたちは、横断研究や縦断研究により、うつ病の病態や抗うつ薬の作用機序にかかわる可能性のある複数の代謝物質を同定しました (図5)(Sci Rep 2017)。今後はこれらの研究成果を基に、診断マーカーの開発や創薬につなげたいと考えています。
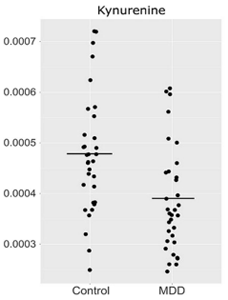
(図5)Sci Rep 2017より引用